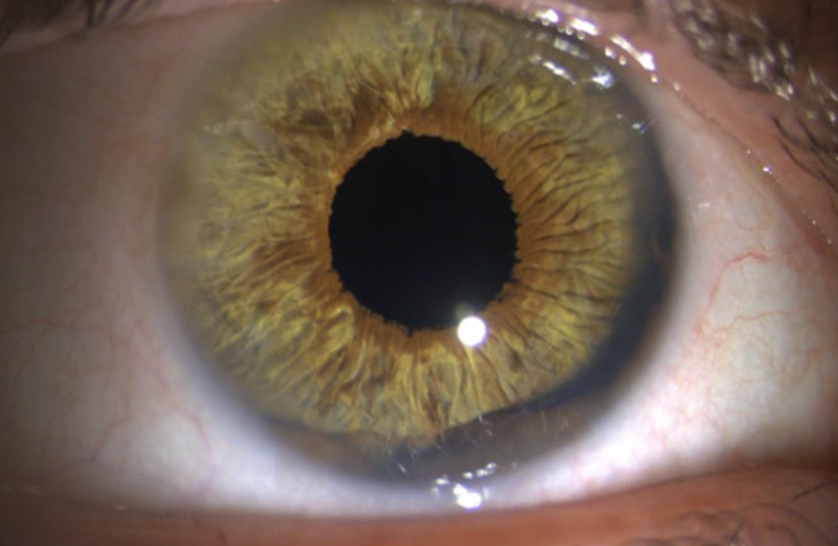
A Agência Nacional de Vigilância Sanitária aprovou, no início deste ano, a primeira prótese de íris para uso no Brasil. Trata-se da ArtificialIris®, produzida na Alemanha pela HumanOptics e que será distribuída em território nacional pela Advance Vision. Este implante tem longo histórico de uso, inicialmente no mercado europeu, desde 2008, e foi aprovado pelo FDA para uso nos Estados Unidos em 2018.
Pacientes portadores de aniridia total ou parcial sofrem de intensa fotofobia. Além disso, a qualidade de visão é prejudicada pela diminuição de sensibilidade ao contraste e fenômenos ópticos como glare e halos. Estudos comprovam o impacto na qualidade de vida e visão em pacientes implantados com esta prótese, assim como sua segurança. Em uma coorte de portadores da síndrome de aniridia congênita, mais de 95% dos pacientes relataram redução de fotofobia e glare. No ensaio clínico multicêntrico conduzido durante processo de aprovação pelo FDA, foi obtido um ganho médio de 15,4 pontos no questionário de função visual VFQ-25, não houve nenhum caso de per- da de duas ou mais linhas atribuídas ao implante, e a perda de células endoteliais foi de 5,3% e 7,2% no sexto e 12º meses de pós-operatório, respectivamente.
A prótese é dobrável e feita de polímero de silicone hidrofóbico, podendo ser injetada por uma incisão de até 2,8 mm. Possui um diâmetro total de 12,8 mm, que pode ser trepanado para o diâmetro adequado a cada olho, e uma abertura pupilar fixa de 3,35 mm. Este diâmetro pupilar é efetivo em bloquear grande parte dos raios luminosos, ao mesmo tempo em que permite adequada visualização do segmento posterior e até mesmo a realização de cirurgia vítreorretiniana. A face posterior é preta para bloqueio completo dos raios luminosos, enquanto a face anterior é colorida para efeito estético.
Clique aqui para ler o artigo na íntegra
Autor
 GABRIEL B. FIGUEIREDO
GABRIEL B. FIGUEIREDO
D’Olhos Hospital Dia, São José do Rio Preto, SP.